ELEKTROCHEMICK╔ ╚L┴NKY
 |
| Galvaniho
"₧ivoΦiÜnß" elekt°ina |
Italsk² p°φrodov∞dec a lΘka° Luigi
Galvani (1737 - 1798) p°i pitvßnφ ₧ab zpozoroval (vlastn∞ prvnφ si toho vÜimla
jeho ₧ena), ₧e sebou ₧abφ steh²nka polo₧enß na plechu p°i dotyku operaΦnφho
no₧e Ükubajφ. V letech 1780 a₧ 1790 provedl Galvani mnoho pokus∙ s ₧abφmi
steh²nky. Myln∞ se domnφval, ₧e cukßnφ ₧abφch steh²nek zp∙sobuje
"₧ivoΦiÜnß" elekt°ina.
Na pokusy Luigi Galvaniho navßzal jin² italsk² fyzik Alessandro Volta (1745 -1827). Zjistil, ₧e
jevy, kterΘ pozoroval Galvani, zp∙sobuje dotyk dvou r∙zn²ch kov∙ odd∞len²ch vlhkou
lßtkou. Sv∙j objev zve°ejnil roku 1800 v Lond²n∞.
Alessandro Volta sestrojil prvnφ elektrick² Φlßnek a na Galvaniho poΦest nazval
vyrßb∞n² proud proudem galvanick²m. Odtud pochßzφ i nßzev pro dneÜnφ galvanickΘ Φlßnky.
 |
| Znali galvanickΘ Φlßnky skuteΦn∞ ji₧
p°ed poΦßtkem naÜeho letopoΦtu ? |
OvÜem prvnφ elektrick² Φlßnek mo₧nß fungoval o mnoho stoletφ d°φve. V jednom
bagdßdskΘm muzeu je uchovßvßn elektrick² Φlßnek z obdobφ parthskΘ °φÜe (250
p°. n.1. 224 n.1.). V nßdob∞ z pßlenΘ hlφny asi 18 cm vysokΘ je umφst∞n 10 cm
vysok² vßlec z m∞d∞nΘho plechu. Äeleznß tyΦinka provleΦenß vφΦkem vßlce je
ode dna i od vφΦka m∞d∞nΘho vßlce izolovßna asfaltem. N∞kte°φ v∞dci se
domnφvajφ, ₧e jako elektrolyt pravd∞podobn∞ slou₧ila vymaΦkanß Ü¥ßva z hrozn∙.
Tento zdroj stejnosm∞rnΘho proudu se mohl pou₧φvat ke galvanickΘmu pozlacovßnφ
r∙zn²ch m∞d∞n²ch nebo st°φbrn²ch nßdob, Üperk∙ a jin²ch p°edm∞t∙.
Elektrolyty
Elektrolyt je kapalina, ve kterΘ
dochßzφ ke Üt∞penφ molekul na ionty zßpornΘ
anionty a kladnΘ kationty. K rozkladu elektrolytu dochßzφ
·Φinkem stejnosm∞rnΘho proudu.
ElektrickΘ pole mezi elektrodami
p°ipojen²mi ke zdroji nap∞tφ zp∙sobφ, ₧e se anionty pohybujφ k anod∞ (kladnß elektroda) a kationty
p°itahuje katoda (zßpornß elektroda). Elektrickou vodivost elektrolytu zp∙sobuje
uspo°ßdan² pohyb iont∙. V elektrolytu se vytvß°φ rovnovßha kladn²ch a zßporn²ch
iont∙ a elektrolyt navenek p∙sobφ jako elektricky neutrßlnφ.
Po dopadu na zßpornou elektrodu si z nφ kationty doplnφ chyb∞jφcφ elektrony a
vznikne neutrßlnφ atom. Anionty p°i
dopadu na anodu sv∙j nßboj odevzdßvajφ. Neutrßlnφ Φßstice uvoln∞nΘ na
elektrodßch neustßle reagujφ mezi sebou, s elektrolytem nebo i s elektrodami.
Elektrolyt mß tzv. iontovou vodivost, kterß umo₧≥uje, ₧e v elektrickΘm poli mezi elektrodami v elektrolytu
prochßzφ proud.
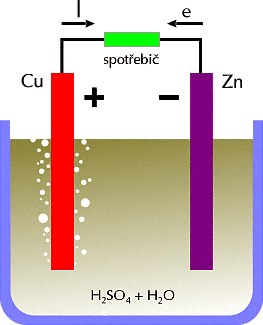 |
Princip galvanickΘho Φlßnku.
Cu - m∞d∞nß elektroda, Zn - zinkovß elektroda,
I - proud, e - sm∞r elektron∙ |
GalvanickΘ Φlßnky
GalvanickΘ Φlßnky vyu₧φvajφ
chemickou reakci, p°i nφ₧ se uvol≥uje energie ve form∞ elektrickΘho pole. P°i
chemickΘ reakci mß molekula nov∞ vzniklΘ slouΦeniny menÜφ energii ne₧ souΦet energiφ Φßstφ, z nich₧
vznikla.
Galvanick²ch Φlßnk∙ existuje mnoho druh∙. N∞kterΘ se dajφ opakovan∞ nabφjet,
proto₧e elektrochemickΘ d∞je, kterΘ v nich probφhajφ, jsou vratnΘ.
P∙vodnφ Φlßnky byly mokrΘ - s tekut²m elektrolytem. Dnes se nejvφce pou₧φvajφ suchΘ
Φlßnky, je₧ majφ mezi elektrodami p≤rovitou hmotu nasycenou elektrolytem. Montß₧
such²ch Φlßnk∙ je velmi jednoduchß. SuchΘ Φlßnky by se vlastn∞ m∞ly oznaΦovat
jako vlhkΘ, proto₧e ·pln∞ bez vody by elektrolyt nep∙sobil.
NejjednoduÜÜφ galvanick² Φlßnek se sklßdß z elektrolytu a dvou elektrod.
Jako elektrolyt se pou₧φvß kyselina sφrovß (H2SO4). Kladnß
elektroda je z m∞di (Cu) a zßpornß ze zinku (Zn). P°i z°ed∞nφ kyseliny sφrovΘ
vodou (H2O) uvol≥ujφ molekuly vody pevnou vazbu molekul kyseliny sφrovΘ,
kterß se rozÜt∞pφ na kladnΘ a zßpornΘ ionty. Mezi nßboji je ale rovnovßha a
elektrolyt z∙stßvß elektricky neutrßlnφ.
P°i pono°enφ zinkovΘ elektrody do elektrolytu se zaΦne zinek rozpouÜt∞t a jeho
kationty nabijφ elektrolyt kladn∞. Na elektrod∞ z∙stanou volnΘ elektrony a elektroda
se nabije zßporn∞. M∞∩ se v roztoku kyseliny sφrovΘ rozpouÜtφ mΘn∞ ne₧ zinek.
Mezi kladnou a zßpornou elektrodou se objevφ nap∞tφ 1,05 V.
Jestli₧e na svorky galvanickΘho Φlßnku p°ipojφme spot°ebiΦ, poruÜφ se rovnovß₧n² stav,
elektrony se p°es spot°ebiΦ odvßd∞jφ ze zinkovΘ elektrody na elektrodu m∞d∞nou a
vodφk se vyluΦuje na kladnΘ elektrod∞ nebo unikß z elektrolytu. Tφm je poruÜena
rovnovßha mezi ionty a vznikß sφran zineΦnat², kter² se usazuje v nßdob∞
galvanickΘho Φlßnku. Proto₧e tak v roztoku ub²vajφ ionty zinku, dochßzφ k novΘmu
rozpouÜt∞nφ zinkovΘ elektrody. Pon∞vad₧ vodφk, vylouΦen² na kladnΘ elektrod∞,
by se op∞t sluΦoval a sni₧ovalo by se nap∞tφ Φlßnku, odstra≥uje se tento
nep°φzniv² jev depolarizßtorem, kter²m se elektroda obalφ. Depolarizßtor je lßtka
bohatß na kyslφk, jen₧ vß₧e vodφk za vzniku vody.
 |
|
Such² LeclanchΘ∙v Φlßnek.
1 - zßpornß (-) zinkovß elektroda, 2 - kladnß (+) uhlφkovß elektroda, 3 -
zahuÜt∞n² elektrolyt, 4 - depolarizßtor |
|
Nejpou₧φvan∞jÜφmi jsou suchΘ LeclanchΘovy Φlßnky. Kladnß elektroda, kterou
tvo°φ uhlφkovß tyΦinka, je umφst∞na v sßΦku s depolarizßtorem. Depolarizßtor
tvo°φ sm∞s oxidu manganiΦitΘho s grafitem a slou₧φ k odstran∞nφ ·Φink∙
vodφku, jen₧ se vyluΦuje na uhlφkovΘ elektrod∞. Vodφk je izolant, a kdyby pokryl
anodu, naruÜil by funkci Φlßnku. Zßpornou elektrodu tvo°φ zinkovß nßdoba.
Elektrolytem je chlorid amonn² zahuÜt∞n² pastou, aby se neroztΘkal.
V LeclanchΘov∞ Φlßnku probφhß nevratn² d∞j, proto se nedß nabφjet. V²hodou
LeclanchΘova Φlßnku je nφzkß v²robnφ cena a jednoduchß konstrukce. Jeho svorkovΘ
nap∞tφ je 1,5 V.
GalvanickΘ Φlßnky pat°φ mezi primßrnφ Φlßnky - m∙₧eme z nich
elektrick² proud odebφrat, ani₧ jsme jim ho p°edtφm "dodali". JednotlivΘ
druhy jsou zalo₧eny na r∙zn²ch elektrochemick²ch systΘmech. V²konn∞jÜφ, ale takΘ
dra₧Üφ ne₧ LΘclanchΘovy Φlßnky jsou alkalickΘ a rtu¥ovΘ Φlßnky. GalvanickΘ
Φlßnky mohou mφt vßlcovΘ, plochΘ i hranatΘ tvary. Pou₧itφ galvanick²ch Φlßnk∙
je velice ÜirokΘ, nap°φklad v kapesnφch svφtilnßch (monoΦlßnky, tu₧kovΘ a
plochΘ baterie), rozhlasov²ch p°φstrojφch, elektrick²ch zvoncφch, p°enosn²ch
vysφlaΦφch a p°ijφmaΦφch, drobn²ch p°φstrojφch (elektrickΘ hraΦky, holicφ
strojky, magnetofony, vrtaΦky, elektrickΘ hodiny) atd.
PalivovΘ Φlßnky
DalÜφm druhem primßrnφch Φlßnk∙ jsou perspektivnφ palivovΘ Φlßnky. Oxidacφ
("spalovßnφm") chemick²ch lßtek se u nich chemickß energie m∞nφ na energii elektrickou. Obdobn∞ jako u
galvanick²ch Φlßnk∙ tedy i zde probφhajφ chemickΘ reakce, ale rozdφl je v tom, ₧e
se k jednΘ elektrod∞ p°ivßdφ palivo (nap°. vodφk)
a ke druhΘ okysliΦovadlo (nap°. kyslφk).
B∞hem provozu lze u palivov²ch Φlßnk∙ palivo dopl≥ovat, tak₧e mohou pracovat
trvale. Klasick² palivov² Φlßnek je kyslφko-vodφkov² Φlßnek, kter² mß dv∞
p≤rovitΘ platinovΘ elektrody, mezi nimi₧ je elektrolyt. Nap∞tφ Φlßnku je asi 1,1
a₧ 1,23 V. PalivovΘ Φlßnky se pou₧φvajφ v elektromobilech.
U primßrnφch Φlßnk∙ po dozn∞nφ chemickΘho pochodu jsou aktivnφ hmoty
znehodnoceny.
|
 |
|
Proslul² Volt∙v sloup. Sloupec
st°φbrn²ch a zinkov²ch kotouΦ∙ prolo₧en²ch vlhkou plstφ. |
Akumulßtory
Mß-li molekula nov∞ vzniklΘ slouΦeniny v∞tÜφ energii ne₧ jejφ slo₧ky, musφ
se - aby chemickß reakce prob∞hla - do systΘmu nejprve energie dodat. Vznikne chemicky
nestabilnφ slouΦenina, je₧ se za urΦit²ch podmφnek rozpadß a uvol≥uje svou
energii. Tφmto zp∙sobem se m∙₧e energie urΦitou dobu "skladovat" - akumulovat. Tento jev se vyu₧φvß
v akumulßtorech.
U akumulßtor∙ rozpadem ·ΦinnΘ chemickΘ lßtky vznikß nap∞tφ. Tato chemickß lßtka se vytvß°φ
na elektrodßch p°i nabφjenφ akumulßtor∙. NejΦast∞ji se pou₧φvajφ olov∞nΘ,
niklkadmiovΘ a oceloniklovΘ akumulßtory.
Olov∞nΘ akumulßtory majφ ob∞
elektrody z olova. Kladnou elektrodu u nabitΘho akumulßtoru pokr²vß vrstva
kysliΦnφku oloviΦitΘho. Nßdoba olov∞nΘho akumulßtoru b²vß z tvrzenΘ pry₧e,
plastu nebo ze skla. Elektrolytem je kyselina sφrovß, kterß se °edφ destilovanou
vodou. KladnΘ elektrody majφ tvar m°φ₧φ a jsou vypln∞ny pastou nebo jsou
₧ebrovanΘ. Nejmodern∞jÜφ akumulßtory pou₧φvajφ jako kladnΘ elektrody trubkovΘ
desky, kterΘ majφ a₧ p∞tkrßt vyÜÜφ ₧ivotnost.
Okolo kladn²ch elektrod jsou umφst∞ny elektrody zßpornΘ, kter²ch je tedy o jednu
vφce ne₧ elektrod kladn²ch. KladnΘ a zßpornΘ elektrody jsou od sebe odd∞leny
izolaΦnφmi vlo₧kami.
Nap∞tφ jednoho olov∞nΘho akumulaΦnφho Φlßnku b²vß 1,85 a₧ 2,1 V. Jestli₧e
nap∞tφ Φlßnku klesne pod hodnotu 1,85 V, zaΦφnß nevratn² pochod vytvß°enφ
nerozpustnΘho sφranu olovnatΘho, kter² akumulßtor znehodnotφ. Aby se tomu
zabrßnilo, je pot°eba p°i poklesu nap∞tφ na hodnotu 1,85 V akumulßtor ihned nabφt.
Olov∞nΘ akumulßtory vydr₧φ asi 300 nabφjecφch cykl∙. Pou₧φvajφ se v motorov²ch
vozidlech, najdete je prakticky v ka₧dΘm automobilu.
AlkalickΘ akumulßtory pou₧φvajφ jako elektrolyt hydroxid draseln² s p°φsadou,
z°ed∞n² destilovanou vodou.
OceloniklovΘ i niklkadmiovΘ akumulßtory jsou alkalickΘ akumulßtory. V porovnßnφ s
olov∞n²mi akumulßtory jsou asi Φty°ikrßt dra₧Üφ. Jejich elektrolyt mrzne a₧ p°i
-60░C a po rozmrazenφ je akumulßtor op∞t schopen Φinnosti. Majφ ni₧Üφ nap∞tφ
(1,1 a₧ 1,8 V), delÜφ ₧ivotnost a vy₧adujφ menÜφ nßroky na ·dr₧bu. Pou₧φvajφ
se nap°. v akumulßtorov²ch vozφcφch.
P°i nabφjenφ akumulßtor∙ (vÜech typ∙) je v₧dy nutnΘ otev°φt jejich zßtky, aby
se vznikajφcφ vodφk, kter² se vzduchem tvo°φ t°askavou sm∞s, dostal ven.
Specißlnφ st°φbrozinkovΘ akumulßtory dob°e snßÜejφ zkraty a
mechanickΘ ot°esy a jsou mimo°ßdn∞ lehkΘ. Jsou ovÜem drahΘ, a proto se
pou₧φvajφ jen v letectvφ, u zßvodnφch automobil∙, ve sd∞lovacφ technice a v
dalÜφch specißlnφch p°φpadech. St°φbrokadmiovΘ akumulßtory
majφ obdobnΘ provedenφ jako akumulßtory st°φbrozinkovΘ, ale vyznaΦujφ se navφc
dlouhou ₧ivotnostφ.
Akumulßtory se pou₧φvajφ jako startovacφ baterie motorov²ch vozidel, u
akumulßtorov²ch nßkladnφch vozφk∙, elektromobil∙, v telefonnφch ·st°ednßch, v
elektrickΘ trakci, pro nouzovß osv∞tlenφ, pro p°enosnΘ svφtilny i ke stßlΘmu
osv∞tlovßnφ atd. Dajφ se vyrßb∞t i v mal²ch rozm∞rech a vzduchot∞sn∞ uzav°enΘ.
Jejich tvary mohou b²t vßlcovΘ, plochΘ i hranatΘ. Majφ dlouhou ₧ivotnost a
pou₧φvajφ se i do p°enosn²ch za°φzenφ (hraΦky, radiop°ijφmaΦe, fotografickΘ
blesky ap.).
AkumulßtorovΘ Φlßnky jsou Φlßnky sekundßrnφ. P°i nabφjenφ
proudem z jinΘho zdroje se aktivujφ ΦinnΘ hmoty Φlßnku tak, ₧e lze pozd∞ji
chemicky vyvolat jejich vybφjenφ, p°i kterΘm se zφskßvß elektrickß energie. Jde o
vratn², opakovateln² elektrochemick² pochod.
|

 Aktußlne
Encyklopedie energie
Soute₧
Bheliom
Aktußlne
Encyklopedie energie
Soute₧
Bheliom 
