| ELEKTŘINA
Z CITRÓNU Má-li obvodem procházet trvalý elektrický proud, potřebujeme zdroj elektrického
napětí. Zhotovíme si několik jednoduchých galvanických článků a prozkoumáme jejich vlastnosti.
Základní potřeby: - elektrody z různých kovů
- sklenice
- citron, citronový koncentrát, ocet, soda, kuchyňská sůl apod.
- voltmetr, vodiče
- kalkulačka s displejem LCD
Provedení pokusu:
Galvanický článek se skládá ze dvou různých elektrod a elektrolytu. Jako elektrody použijeme odřezky
kovů (měděný či hliníkový drát, hřebík, pozinkovaný plech ...), elektrolytem budou různé roztoky. Elektrody můžeme zapíchnout i do ovocných plodů a vyrobit
třeba "citronový" nebo "jablečný" článek. | 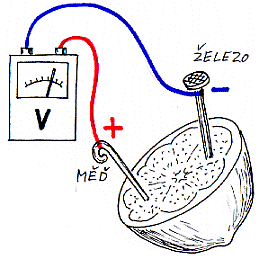 |
Voltmetrem připojeným k elektrodám budeme zjišťovat velikost napětí různých článků v závislosti na druhu elektrod,
jejich rozměru, druhu elektrolytu a jeho koncentraci. Naměřené hodnoty při různých kombinacích elektrod a elektrolytů zapíšeme do tabulky:
| 1. elektroda | 2.
elektroda | elektrolyt |
napětí (V) |
| měď | hliník |
ocet | 0,35 |
| . . . . | . . . . | . . . . | . . . . |
Tyto jednoduché články nemohou dodávat do obvodu dostatečně silný proud a proto nemohou napájet např. žárovku
kapesní svítilny. Pokud však zapojíme 2 - 3 články do série, získáme větší napětí a můžeme rozsvítit svítivou diodu LED. Pokud se nerozsvítí, přehodíme
přívodní vodiče. Našimi galvanickými články však můžeme napájet i kalkulačku nebo hodinky s displejem z kapalných krystalů, které mají nepatrnou spotřebu. Zase
ovšem musíme dát pozor na správnou polaritu článku. 
O existenci elektrického napětí se můžeme přesvědčit také vlastním jazykem: k elektrodám připojíme delší vodiče
a jejich konce přiložíme na jazyk. Pocítíme jemné svědění, které svědčí o procházejícím elektrickém proudu. Tímto způsobem však nikdy nezjišťujeme napětí skutečných zdrojů!
Trochu teorie: První galvanický
článek sestrojil Alessandro Volta. Jako elektrody použil měď a zinek, elektrolytem byl zředěný roztok kyseliny sírové. Nejběžnějším
galvanickým článkem je tzv. suchý článek se zápornou zinkovou a kladnou uhlíkovou elektrodou, elektrolytem je v něm roztok salmiaku, depolarizátorem je burel.
Depolarizátor v galvanických článcích odstraňuje zplodiny chemických reakcí a prodlužuje jejich životnost. Vybité galvanické články obsahují nebezpečné látky
a proto nepatří do běžného odpadu. Kromě primárních galvanických
článků se používají také akumulátory, které můžeme opakovaně mnohokrát nabíjet a získat z nich tak podstatně víc elektrické energie.
Olověný akumulátor najdeme v každém automobilu, malými NiCd akumulátorky se napájí např. walkmany nebo kapesní svítilny. |

 Aktuálně
Encyklopedie energie
Soutěž
Bheliom
Aktuálně
Encyklopedie energie
Soutěž
Bheliom 
